1、元素概述
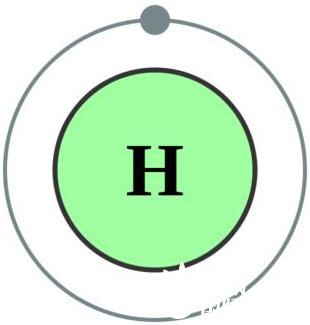
氢元素(Hydrogenium)是元素周期表中的第一号元素,化学符号为H,其原子仅由1个质子与1个电子组成,原子质量为1.00794u(1u就定义为C12原子的1/12)。

氢原子示意图
早在1671年,波义耳首次通过酸和金属制备了氢气。到1766年,卡文迪许发现氢气是一种独立物质。直到1783年,拉瓦锡将其命名为“Hydrogenium”,意为“生成水的物质”(其中“hydro-”是“水”,“-gen”是“生成”,”-ium"是元素通用后缀)。到19世纪30年代,国内根据合信编写的《博物新编》将其译为“氢”,即最轻的元素。
氢元素作为宇宙里最古老(大爆炸后“仅”37.9万年就产生的两种元素之一)、最多(总数量的90%与总质量的75%)、最轻的元素,分布在已知世界的每一个角落,具有着无可比拟的重要作用,它主宰了宇宙的物质世界,也组成并孕育了生命。
在宇宙中主星序恒星主要都是等离子态的氢(起源于氢分子云),而地球上我们身边游离态的氢单质就比较罕见了(甚至氢不是地球上含量最多的元素)。
2、发现历史
2.1、认识的历程
受过的义务教育告诉大家,氢元素是元素周期表的一号元素,而且酸中的氢离子可以和金属活动性比它更活泼的金属反应并产生氢气。但是,这个今天看来简单的知识,却经历了两三百年的时间才形成。
早在16世纪,瑞士医生帕拉塞尔苏斯就发现铁屑和硫酸能产生可燃气体,但因为医生工作繁忙没继续研究下去,错过了在化学史上留名的机会;到了17世纪初,比利时科学家海尔蒙特也研究了氢气,发现了氢气可燃但不助燃的性质,但也没能更进一步;直到17世纪后半叶,英国化学家波义耳追随老师海尔蒙特的脚步进行了制备氢气的实验并展开研究,描述了气体的性质;直到1776年,英国化学家卡文迪许终于发现这是一种新的单质,与反应原料无关,并分离出氢气单质、测量了与空气混合爆炸的极限(9.5%~65%);在后续研究中,卡文迪许进一步发现新单质气体密度为空气的9%。
在1784年,卡文迪许又通过实验发现2单位体积的氢气与1单位体积的氧能刚好燃烧生成水,证明了水是氢和氧的化合物(但是卡文迪许和前几年制备氧气的舍勒和普利斯特里都是“燃素说”的拥趸,对自己的实验都懵了,自己支持的学说解释自己的实验矛盾重重,不知道其实氢是一种新元素而水不是……最后还得是同时氧气制备先驱的拉瓦锡站出来,通过实验分解了水,推翻了“燃素说”才使实验得到合理解释),这也是元素名称“生成水的物质”的由来。

普利斯特里、拉瓦锡与舍勒
前面这些大神各个是化学史上重要人物,他们的研究推动着人类认知的前进,虽然像卡文迪许一样很多科学家都有自己的局限性,但他们做出的贡献也是不可磨灭的,人类认识、利用氢的征途就此展开。
2.2、进一步研究
有了从氢气产生水的实验后,相反的电解水反应直到1800年才由尼科尔森、卡莱尔和里特实现并分开收集两种气体(后来人们一直在寻找高效的分解水的方法,希望能使氢能源更便宜、便捷)。
氢元素作为第一主族元素(碱金属族),虽然和同族的“锂钠钾铷铯钫”等元素不一样,没有金字旁,但是同样最外层只有一个电子,于是它们相似的性质也使人难免去猜测,金属氢是否有制备的可行性。
实验发现,在极端高压下氢分子间共价键会断裂,外层电子释放形成一片“电子的海洋”,与一般金属通过自由电子导电的性质一样,这种状态通常存在于大行星与恒星内核之中。金属氢不仅具有金属特性,且因密度高(是液氢的7倍)而具有高能量密度(218kJ/g),是理想的航空推进剂与炸药材料,此外,也是核聚变和超导的理想材料。

通过超高压制备金属氢
但是除了固液气三态和金属氢之外,氢是否还有别的状态呢,氢负离子是否能在离子型氢化物外存在呢?实际上,自然环境甚至身边都会有氢等离子体的存在,它们能在高温、无氧还原的环境下产生(如火山岩浆冷却时),也能通过真空等离子体放电管人工制造,还会存在于生物细胞内ATP(三磷酸腺苷)产生过程中存在。
3、元素介绍
3.1、元素诞生
谈到氢元素的起源,理应从作为宇宙起源主流观点的大爆炸理论说起:大爆炸理论认为现在的宇宙是由133~139亿年前一个高密度且高温的太初状态(可以认为是时间的起点,空间的源头)扩展而来的,在这个过程中,宇宙的温度随着物质的飞散而降低,各种粒子开始逐渐的产生。
在大爆炸发生后10^-12秒内,各种粒子包括质子、中子与其对应的反粒子开始形成,玻色子、中微子、电子、夸克以及胶子开始稳定下来。此时温度下降至足够程度,电弱相互作用开始分解为电磁相互作用与弱相互作用。
到10^-4秒数量级时,电子、中微子与其对应的反粒子等轻子开始与其他粒子的平衡相中分离。
在0.01秒后,温度还有10^11K量级,此时粒子以光子、电子、中微子为主,质子仅占总数的1/10^9。
在0.12秒后,温度降至3*10^10K,中子质子比从1.0降低到0.61。
在1.1秒后,温度大约为10^10K,此时中微子向外逃逸,正负电子湮没反应开始出现,但是核力仍无法束缚中子和质子。
在13.83秒后,温度降至3*10^9K,此时在核力的约束下氢、氦类原子核开始形成。
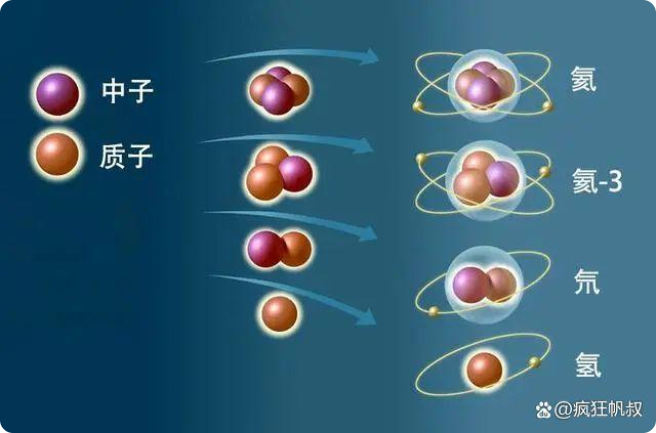
原子核形成
在100秒后,温度降至10^9K以下,粒子转变基本停止。在宇宙诞生的前4分钟内,形成现在世界的所有原材料基本都已经产生,所有反应的初始条件也都已具备,一出好戏开始拉开帷幕。
在这出戏唱到37万年时,第一个小高潮到来–此时宇宙温度大约为3000K,此时氢原子核氦原子们已经变成了大家所熟知的形态,整个宇宙的演化正式转进现有模式中。可以说这个时候就已经决定今天的世界是必定会产生的了。
至于为什么是氢和氦先登场呢?这与形成他们的原材料是有很大关联的。在大爆炸的早期阶段,宇宙里的粒子无非就是质子、中子、光子、电子、中微子等,以及一些氘、氦原子核等基本粒子的简单组合粒子。而当到30万年左右时,中微子已不再参与原子形成,而光子并不参与原子形成,因此主要由质子、中子、电子和α粒子形成最初的原子。在上述粒子中,质子数量最多,是α粒子的11倍,中子少得可怜,且质子和α粒子可直接作为原子核,因此最初的原子氢占了92%,氦占了8%,以及很少的氘(即使过了140亿年的现在,氢依然占了90%,氦占了9%)。
还有一个不容易被注意的问题,为什么宇宙在诞生的一瞬间就已经产生了几乎所有的粒子,但为什么直到30万年后才会形成原子呢?这就要从温度与粒子的能量来解释了–在宇宙诞生之初,超高的温度使粒子具有极强的能量,导致其无法被作用力所束缚。在十多秒后核力才开始将乱窜的质子和中子束缚到一起形成氦核,而氘核更不稳定,直到四分钟后才形成。此时温度还不够低,直到30万年的时间才使温度满足原子核与电子相互作用的电磁相互作用成为它们之间主导的作用。
3.2、元素含量
当我们凝望夜空,在夜空中的点点繁星,是无处不在的氢元素正在向氦元素的转变时放出的光辉。
放眼今天的宇宙,无穷的星系包含了数不清的恒星和星云,而这每一颗恒星和每一片星云,都是由90%的氢原子和9%的氦原子所构成,可以说,氢元素是整个宇宙占主导地位的元素,数量是其他元素总和的100倍。
把目光收回到我们所位于的太阳系,即使在这里,氢元素也占有超过81.75%的数量比例,依然是最常见的元素。
让我们聚焦身边,在地球环境上就与整体宇宙环境不大一样,在这里较少存在游离状态的氢元素,总体上以水中的氢元素、土中的氢元素和有机物中的氢元素的形式存在。在地壳中,氢元素只占原子总数的17%,占总质量的1%;空气中氢气只占约二百万分之一。
3.3、元素家族
从课本上我们知道氢元素一家有三兄弟,分别是氕、氘和氚(唯一同位素有专有名称的元素–历史上每种同位素都有特有名称,现已不再使用)。在自然环境下氕是主体,占了总量的99.99%,而氘、氚在的含量可以忽略不计。但是,实际上在实验室环境中,还可以制备4号到7号的氢同位素。

氢同位素兄弟
氕(氢-1,Protium,也记作P,现P已作为磷的符号):
原子核只有一个质子,丰度达99.98%,是结构最简单的原子。是日常使用中最常见的同位素种类。
氘(氢-2,Deuterium,也记作D):
原子核由一个质子和一个中子组成,氢的稳定形态同位素,也称为重氢,自然环境下含量为氕的7000分之一。氘少量存在于天然水中,可作为中子减速剂与冷却剂用于核反应(作为中水的一部分),将来也许有成为核聚变燃料的潜力,也可在生物与化学领域作为示踪原子。
氚(氢-3,Tritium,也记作T):
原子核由一个质子和两个中子所组成,也称为超重氢。氚带有放射性,会发生β衰变,半衰期为12.43年,因此大量吸入或摄入都会对人体产生内照射损伤(一种放射损伤)。氚在自然界中极少,主要通过核反应产生,主要用于热核反应,也用作发光材料与化学生物学实验的放射性标识。
氢-4:
原子核由一个质子和三个中子所组成。氢-4主要通过用氘原子核轰击氚原子核产生,氚原子核会在该过程中吸收一个氘原子核上的中子生成氢-4的原子核。氢-4的半衰期为9.93696×10^-22秒。
氢-4.1:
原子核由二个质子和二个中子所组成,结构上类似于氦(但其中一个电子是渺子,轨道相对外层电子轨道与原子核很接近,近似视作原子核的一部分)是一种奇异原子。一个渺子重约0.1u,故命名为氢-4.1。在化学反应中氢-4.1原子可参加反应,性质更接近氢而不像氦原子。
氢-5:
原子核由一个质子和四个中子所组成。氢-5主要通过用氚原子核轰击氚原子核产生,氚原子核会在该过程中吸收一个氚原子核上的两个中子生成氢-5的原子核。氢-5的半衰期为8.01930×10^-22秒。
氢-6:
原子核由一个质子和五个中子所组成,非常不稳定,半衰期为3×10^-22秒。
氢-7:
原子核由一个质子和六个中子所组成,非常不稳定,半衰期为2.3×10^-23秒(未经实验验证,理论计算)。
3.4、元素性质
常温常压下,氢气是一种易燃、无色、无味的气体。氢的-1(氢化物)、0(原子)、+1(质子)三种氧化态具有截然不同的化学性质。
氢气分子是相当惰性的,其与氦原子在统一的原子模型里是等电子的。直到1984年,才由库巴斯描述过渡金属与氢分子的配位,其间的作用也被命名为库巴斯键。
与分子状态的稳定不同的是,氢原子在得到一个电子成为氢阴离子(H-)形成氢化物或失去一个电子成为氢阳离子(H+)时就很活泼,不过通常情况下氢离子已更复杂的形式存在。氢与除稀有气体之外几乎所有元素发生反应生成化合物。氢阴离子是强碱和强还原剂,氢阳离子是强酸和强氧化剂(在强酸环境下氢阳离子可轻易将烷烃变成碳正离子)。
在量子力学诞生后,氢作为最简单的原子自然成为了重要的研究对象,对氢原子能级、成键等方面的广泛研究极大的助力了各类理论模型的研究与验证。
3.5、元素用途
氢最为常见元素之一,在日常生活中也有着极为广泛的用途。
氢气首先是一种清洁燃料,制备方便、对环境友好且可以循环生产,具有广阔的前景。氢气在同样质量下具有更高的能量,因此可用来作为航天的燃料(在一百年前也作为热气球的升力来源),支撑人类探索未知。
在1970年飞利浦实验室发现氢可以以氢化物的形式被金属间化合物可逆地吸收之后,电化学储氢的成功使得镍氢电池在千禧年前夕开始普及,相比于传统电池更清洁、更安静、更高效,人类开始更广泛地利用氢能。

镍氢电池
同时,正如在宇宙中无处不在的恒星一般,人类也开始进行氢同位素的可控核聚变研究,期待在可见的未来翻开人类核能使用的新篇章。
最近在金属氢问世后,除了其瞩目的超导材料潜质外,其更强大的储能能力也为将来氢在能源领域的应用带来了更光明的希望。
除了作为能源外,氢气因其还原性在工业上也有许多其他用途。氢气可以用于原油的精炼,可以制造人造油脂,可用于甲醇、氨、盐酸的合成,可用于焊接和金属切割,可用于玻璃熔化,可用于冶金工业,可用于半导体制造等。
除了工业领域外,氢气正在作为一种治疗气体广阔地应用于医疗领域–因为氢能降低各种自由基相关疾病损伤,且具有分子体积小、扩散能力强、理想的生物兼容性、经济等优势,正在更多地受到重视。
4、元素故事
4.1、最著名的兴登堡飞艇事故
众所周知,氢气因为其较小的密度可以为气球、飞艇等类型飞行器提供升力。虽然氢气因为其含量高、易制取、成本低等因素,大大降低了飞行的成本,但是另一点广为人知的缺点也一直形影不离–氢气易燃易爆炸,作为飞艇的主要升力来源需要格外注意火灾等威胁。
上世纪30年代制造的兴登堡号飞艇是德国继齐柏林号之后的第二艘巨型空运飞艇,由16个巨型氢气囊组成,长245米(波音747的3.5倍)、宽41.4米(波音747的6.5倍),可来往于欧洲与美洲之间提供客运服务。

兴登堡号飞艇
但是,因为更为安全的氦气生产成本高、产量低,且美国当时对德国进行了氦气禁运,兴登堡号无法采用全氦方式甚至外氦内氢结构,为后来产生的悲剧埋下了伏笔。
在兴登堡号的最后一次飞行中,兴登堡号因下雨和逆风的原因,比预计时间晚了12小时抵达美国新泽西州莱克霍斯特海军航空总站。为了能赶在最佳降落时间降落飞艇,艇长剧烈操作飞艇导致结构钢索断裂划破了氢气囊,随后氢气外漏弥漫在飞艇各个角落。在降落准备阶段,飞艇上放下的降落牵引绳相当于地线,将飞艇穿过降雨云时积累的电荷都引至地上,电流引起飞艇部分金属部件过热甚至部分位置产生了火花,最终引发了火灾。(还有人为安置炸弹的说法,以及当地农夫因飞艇惊吓致母鸡不下蛋而生气开枪报复的说法,此处不谈。)飞艇尾部发生爆炸后,10秒后艇身大部被火焰笼罩,34秒后变成了一个燃烧的火球,燃烧的骨架轰然坠地……虽然在救援人员的全力挽救下97名成员中有61人死里逃生,但依然有36人葬身火海。

燃烧坠地的飞艇
在此次教训后,全世界各国逐渐不再使用氢气作为飞行器升力来源,我国甚至在近年来逐步禁止氢气球的售卖。
4.2、氢作为万物基础的旧荣光
自从人类开始思考以来,什么是物质世界的基础的问题一直就不缺关注。
早在2400年前的古希腊,泰勒斯就提出了水是万物的基础,引出了有史以来关于世界基础的一系列讨论。在此基础上德谟克里特等人又提出了朴素的原子论,将本问题的争论继续下去。直到今天,随着科学理论的不断发展,对基本粒子的认识不断进步,但是探索依然在继续。
在大量的假说中,英国化学家普鲁特提出了以氢原子作为基础的“普鲁特假说”,在很长一段时间内都统治了物质世界的组成,一时风光无两。

普鲁特
1811年普鲁特刚获得医学学位,在此前不久的1803年道尔顿提出了轰动世界的原子论,指出所有物质都由不同的元素组成。科学家们在震惊中重复实验后也逐步认可了这一学说,有些人开始寻找新的元素,但是普鲁特走出了一条未曾设想的道路–寻找组成不同元素的基础。
当时麦克斯韦、法拉第等大佬也觉得原子有构造的痕迹,普鲁特在此道路上更进一步,认为构成元素的基础就是氢(因为当时发现的元素中,氢相对质量最轻)。既然提出假设后,下一步就是验证,首先所有元素的质量都应该是氢原子的整数倍:普鲁特测算了碘、磷、钠、铁、锌、钾和铍的原子质量,并采用其他科学家已测定的氢和其他元素的原子质量,计算后发现碳是氢的12倍,氮是氢的14倍,钾是氢的40倍,碘是氢的124倍,基本无一例外。于是在1816年,普鲁特搞了个大事情,将结果公之于众,被称为“普鲁特假说”。(因为无法解释为什么氢为万物基础,只是以此为前提进行了论证。)科学界众人感觉脑瓜子嗡嗡的,这些年不好理解的理论是一个接一个,人都麻了……有的人觉得这是“世界至理”,有人觉得纯粹胡闹,两派都在寻找新元素企图支持自己的观点。但是没想到假说非常坚挺,直到100年后的第一次世界大战前夕依旧没能找到什么元素能推翻这个假说(其实不同元素质量只是很接近氢原子的整数倍,只不过测量时被认为是误差遭到大家的忽略)。
正当大家都要认命之时,情况出现了转机–汤姆逊(就是提出新原子模型的那位大物理学家)与其同事阿斯顿对自己发明的质谱仪进行了升级,精度更上一层楼。阿斯顿在收获新玩具后那是爱不释手,对各种元素进行了全面的测量,这下发现了不得了的结果,很多元素尤其是较重的元素其原子质量不是氢原子的整数倍!
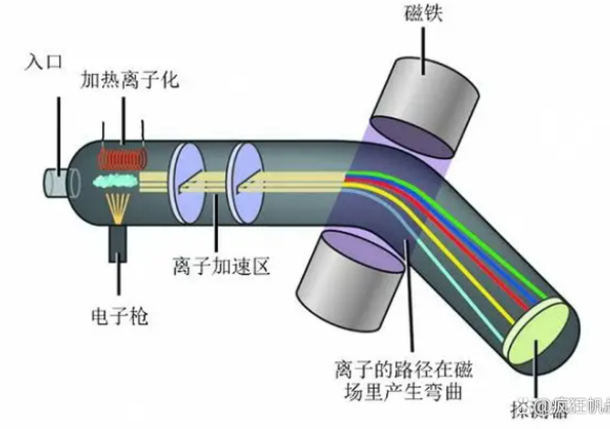
质谱仪原理
至此氢作为万物基础的假说就此被推翻,探寻之路还是要继续下去。在这之后中子、夸克、胶子等陆续登上历史舞台,虽然不知道何时才能或者说是否有一天能够探索到本问题的尽头,但是这并不重要,重要的是人类在这一步一步的探寻中不断前进。
4.3、氢元素的同位素寻找之路
众所周知不同元素以质子数的不同来区分,而同一元素的同位素之间以中子数的不同来区分–例如我们时刻呼吸的氧气就有氧-16、氧-17和氧-18三种,还有广为人知的核材料铀存在相对原子质量在226与242之间的17种同位素等。
在1910年英国科学家索迪提出了同位素假说–存在不同原子量和放射性,但其它性质基本一致的元素变种,因位于元素周期表因而取名“同位素”。在后续1912年质谱仪发生了初步的升级后,各种元素的同位素都开始陆续被发现。在这过程中,科学家们都在争夺命名新元素或同位素的荣耀,但学界渐渐也发现,怎么一直没有一号元素氢的同位素被发现,甚至有人都开始怀疑是不是并不存在氢同位素……以我们现在的认知来看,氢在自然环境下存在氘和氚两种同位素,但因为含量极少导致一次次在研究中被擦肩而过。
在1913年,氘的存在第一次被人们感知到,纽约大学的两位学者和李在测量纯水的密度时发现不同样本的测量结果并不一致,但他们把原因归为水的密度并不唯一的原因,并没有往同位素上去想,遗憾地错过了取得这一历史性成就的机会。
时间到了20世纪20年代最后两年,氧的同位素氧-17和氧-18被发现,引起了极大的轰动,可以说是被发现最具关注度的同位素了–当然了,是在氢同位素被发现之前。到了1931年,伯克利分校的科学家们继发现氧同位素的良好势头之后,又在氢同位素研究上取得了进展,并在当年7月的期刊上发表出来:两位物理学家发现不同方法测得的原子量存在差距,认为氢其实是不同同位素的混合,存在相对质量更大的氢同位素。
美国物理学家尤里在看到这篇文章后就展开了行动,计划在氢样本中分离出氢同位素来。首先第一步工作就是要确定氢同位素的存在,尤里和同事墨菲合作设计了一套方法,通过对原子光谱的比对发现了极其微弱的与氢原子光谱存在细微差别的光谱,可以说是发现了氢同位素存在的确凿证据。但是尤里比较谨慎,为了确保发现稳妥,他决定提升氢同位素的浓度后再测量光谱,这样光谱更明显,可以排除杂质的干扰。

尤里
尤里这一次与布里克韦德合作,设计了一套蒸馏提纯法:在一定的温度下,普遍规律上来说更氢的粒子具有更大的运动速度,更容易从液体中分离出来,留下来的液体中相对质量更大的粒子比例更高。按照这个思路,实验将氢气冷却到液态,然后在14K的温度下逐渐蒸发6升液态氢到只剩2立方厘米(0.002升)的程度,结果中的氢同位素谱线强度增强了数倍,即使考虑杂质影响也足以证明氢同位素的存在。
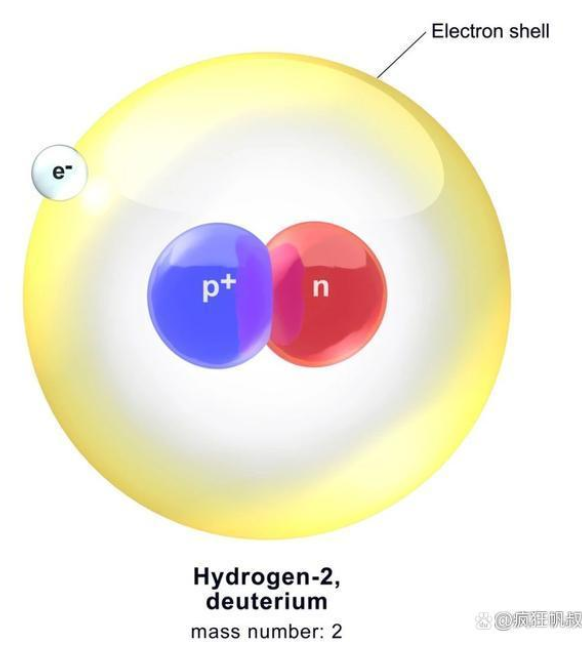
氘原子示意图
有了这样的结果,尤里正式公开了他的发现,于1932年发表了相关论文,随即在1934年凭此发现获得诺贝尔奖(仅两年就获得诺贝尔奖,足见本发现是多么震撼以及重要)。新的同位素发现后,却没有被很快命名,因为氢-2的特殊地位实在引人关注,因此卢瑟福、劳伦斯、密里根等一众大佬都参与了进来,最后被命名为Deuterium(氘,来源为希腊语中的“第二”)。氘由一个质子与一个中子组成,是核子数最少的多核子原子,是研究原子核尺度核力的理想对象,也是引出了一个新的研究学科。
4.4、氢原子光谱成果大放异彩
自从17世纪的某一天牛顿通过棱镜将可见光分解出了七彩色光之后,打开了一扇新的大门,但他也不会想到,这也仅仅是太阳辐射的一部分,也只是波动光学的一部分。到了十九世纪初赫歇尔和里特先后发现了紫外线,进一步拓展了太阳辐射的研究范围。

牛顿与棱镜
在太阳辐射的波长上上有了进展的同时,其他方面也取得了开创性的成果–英国物理学家沃拉斯顿将太阳过通过狭缝之后再经棱镜分解,发现在可见光谱中出现了若干黑色暗线,他推断这是阳光中某些缺失波长,称之为“谱线”。一段时间后,夫琅禾费改进试验后从太阳光谱中数出574条暗纹。在后续的研究中,逐渐证明这些谱线与恒星大气中的元素有关。
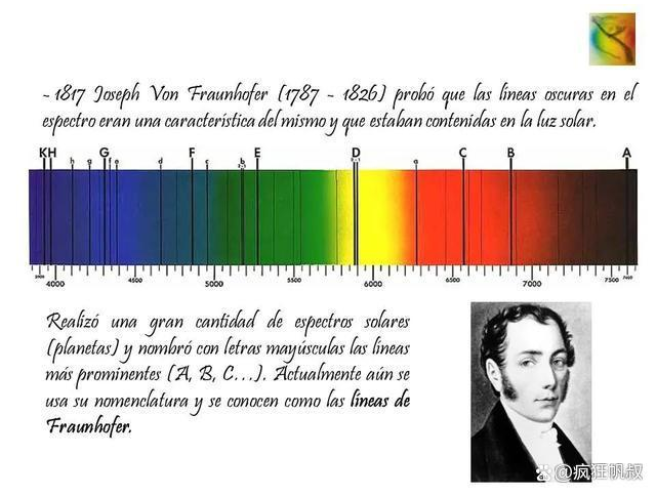
夫琅禾费与太阳光谱
直到19世纪初,英国化学家塔尔博特证明了每种化学元素的谱线都是特有的,可凭借此特性来鉴别元素。

氢原子光谱
此结论一出,科学家们纷纷开始研究各元素的谱线情况。氢元素作为一号元素自然是大家研究的重中之重,其中尤其以瑞典物理学家埃斯特朗(长度单位埃斯特朗对应的那位)的研究最为突出,他发现在氢可见光谱中存在4条暗线,那么它们之间有什么关系呢。
此时“天选之子”巴尔末出现了–为什么这么说呢,因为巴尔末连百科词条里头衔也只是“数学教师”,连数学家都不是,更加不是物理学家,甚至巴尔末百科词条篇幅只有巴尔末公式百科词条的几分之一,可以说巴尔末就是为了提出巴尔末公式而生的。

巴尔末
巴尔末本人对氢或者谱线可以说一点都不了解,他只是应友人的邀请参与一个纯粹的数学问题的研究–寻找四条谱线(656.21nm、486.074nm、434.01nm和410.12nm)所对应的数学规律。巴尔末在一边给学生上课一边探索中,不知经过多少次的探索,还终于在1885年得出了成果,发现四条谱线的波长可以用一个公式得出,分别是公式n=3、4、5与6的时候对应的结果。
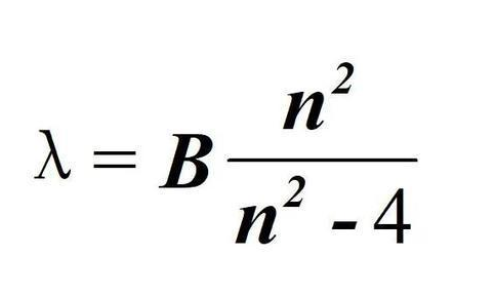
巴尔末公式
此时根据公式巴尔末推出了n的值为7时对应的暗线波长为396.81nm(此时埃斯特朗实际已测得这条线波长,但可能因一些数据没有全部完成验证因而没有公布),与实际测量相差不到四千分之一。
巴尔末公式是巴尔末的才能和努力与幸运女神的眷顾集一身的产物,除了巴尔末本身的原因,也得益于巴尔末选择从最简单的氢元素入手(如果错选了当时也热门的碳、氮或者氧,结果可能就没那么美好了)。虽然在提出时只是一个单纯的等式,但是连巴尔末都没想到的是,巴尔末公式对光谱学和近代原子物理学的发展产生了重要影响,可以说,在科学进步的道路上,氢又一次扮演了重要角色。
4.5、改变物理学的氢原子结构
在针对原子的探索中,有一个最重要的问题,那就是“原子的结构到底是怎么样的”,围绕着这个问题,历史上许多大名鼎鼎的璀璨人物集结了起来。
人们一开始只知道原子是一个很小的粒子,具体结构仍是一无所知,但是这样的情况在1897年出现了变化,这一年汤姆逊发现了电子的存在,但是暂时未完成电子质量与电量的测算,只测算了电子的质量与电量的比值(荷质比),并发现比氢的荷质比小三个数量级。在得到这样的信息后,科学家们纷纷开始按照传统思路开始解释原子的结构–20世纪初,菲茨杰拉德和汤姆逊先后提出氢原子是由500个与1000个电子组成的假说。这两个模型总体没什么区别,只是在电子数量上有少许区别,但它们的问题也是一样的,为什么由带负电的电子组成的原子是电中性的,而且一堆都是负电的粒子如何在相互排斥的作用下保持稳定。针对最初理论存在的问题,开尔文提出假设,如果原子整体是带正电的,带负电的电子镶嵌其中,这样一来问题就解决了。这就是最早的“葡萄干布丁”原子模型。
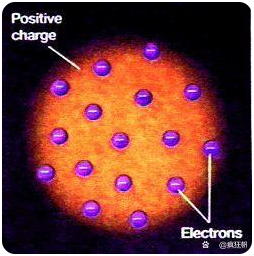
葡萄干布丁模型
随着技术的发展,电子轰击金箔后绝大多数都毫无阻碍并保持原运动方向,这让人们认识到原子内部大部分是空心的,这导致认为原子是实心的“葡萄干布丁”模型的失败。
虽然遭受了挫折,但是科学还是要继续前进的。下一位对此问题发起挑战的是卢瑟福选手–卢瑟福使用α粒子轰击金箔(卢瑟福于1898年发现α粒子,并在1908年测定α粒子带两个正电荷),发现依然是绝大多数粒子正常穿越,只有极少部分受到影响,那么在渺小的电子无法阻挡α粒子的情况下,是什么在起作用呢。与此同时,应卢瑟福邀请,物理学家盖革带门生马士登也参与进来,发现甚至有一部分α粒子被反弹回来,说明源自内部有坚硬并带有强电场的存在。这一实验现在被称为盖革-马士登实验或卢瑟福散射实验。
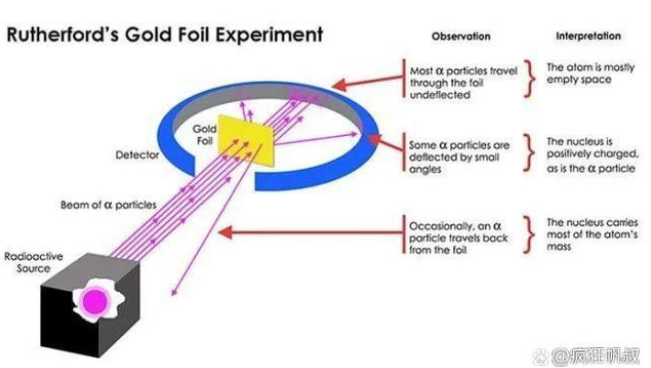
卢瑟福散射实验
在这基础上,卢瑟福结合一系列的实验,提出了由大量电子围绕带正电且质量极大的中心(后来命名为原子核)做圆周运动的卢瑟福原子模型。
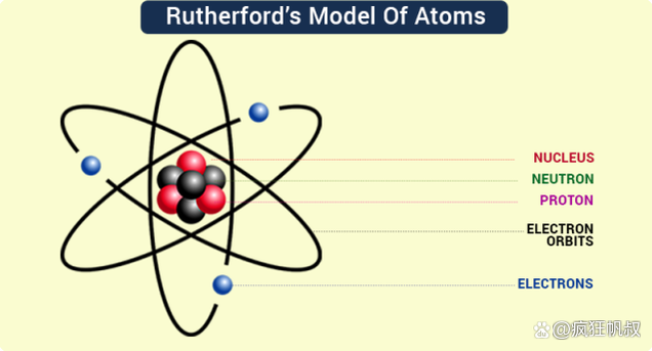
卢瑟福原子模型
在1911年一次卢瑟福赴剑桥大学的原子模型讲座中,后来鼎鼎大名也是关键人物的玻尔被打动了,离开汤姆逊并投入卢瑟福门下,对本课题进行更深入的研究。

玻尔
后来研究中玻尔发现,卢瑟福原子模型还是有致命缺陷的,因为电子在做规律圆周运动中会以电磁辐射的方式损失能量,轨道会越来越低直至与原子核合为一体,这显然是不合理的。作为“气盛”的年轻人,玻尔在一番考虑后跳出了传统的理论束缚,提出了一种全新的假说–原子中的电子轨道不是传统轨道,在其上的电子圆周运动不向外辐射能量,不同的轨道不连续且具有不同的能量状态,电子在不同能量状态的轨道间切换时需要吸收或者放出能量。
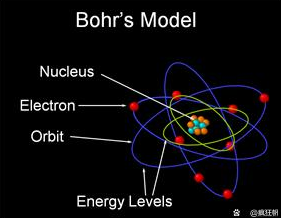
玻尔原子模型
根据假说,玻尔测算出的氢原子半径与电离能均与实验结果非常符合,并且这样的原子模型很好地解释了为什么光谱上会有不连续的暗纹以及巴尔末公式的物理意义,进一步地玻尔提出了电子跃迁行为的公式。
玻尔的原子模型很好解决了一系列长期困扰科学界的问题,也得到了大量的实验支持,但它对传统观念的冲击是巨大的,差点把所有人都冲一个跟头。从今天的角度来看,玻尔原子模型依然有一些缺陷,有些问题还是没有很好地被解释,它的完善还需要量子理论的进一步发展。但是,玻尔模型的影响依然是深远的,今天我们的认识依然是基于此主要基础上的,而且它开创了一门新的学科–量子力学。
4.6、通关氢原子窥探宇宙奥秘
在科学家们逐步的探索中,人们总就知道宇宙与星系主要都是由氢元素组成,绝大多数都是单独的氢原子(中性氢),还有少部分的氢分子与被电离的氢离子。在此基础上,不少人开始关注这些无尽空间中的氢,通过各种各样的方式企图借此对宇宙进一步了解。
在1931年,大名鼎鼎的贝尔实验室正在提供一项业务,通过15米左右波长的无线电波为大西洋上船只提供通信服务,由央斯基负责。但是在实际使用中,因为噪声干扰导致通信质量不佳,于是公司安排央斯基检查原因。央斯基作为技术专家,也是查明了噪声来源:一种是雷暴,另一种是不知源头的嘶嘶声。再经过一年的研究后,1932年央斯基从自己的研究发现这是来自银河系中心天体发出的无线电波,因为太阳辐射影响了电离层所以能通过。这一发现同时也引出了新学科–射电天文。

央斯基
当时的美国社会对此的态度分为两种,民众们对新鲜事物十分追捧,科学界却认为这种噪声没有研究价值,且缺乏研究设备,因此没有引起多大关注。
但是,在1944年荷兰天文学家范德胡斯特做出理论预测,可以观测到星际氢原子光谱的一条21厘米谱线(两种磁矩状态的基态氢原子之间碰撞时从稍高能级跃迁至低能级时释放的光子),认为这是探索宇宙的突破口。于是,各国科学家开始竞相观测争取拔得头筹。但是在这过程中,近水楼台的荷兰天文学界因为火灾摧毁了设备与数据,导致桂冠旁落,美国哈佛大学的珀塞尔带着他的学生尤恩在资金并不充裕的情况下捷足先登,在1951年第一次观测到了来自银河系中心蛇夫座的中性氢21cm谱线,不久后荷兰的米勒团队、澳大利亚的克里斯琴森团队也成功观测到这一现象,三个团队也在同年9月《自然》上同时发表了结果。

珀塞尔的天线
利用中性氢21cm谱线这一工具,天文学家取得了一系列的研究进展,比如更明确了银河系的情况,不仅可以看到可见光条件下被遮挡的部分,还可以通过多普勒效应了解旋转情况。而且这仅仅是一个开始,科学家们陆续发现了太空中的水分子、氨分子和甲醛分子,在1994年还发现了第一个氨基酸分子–乙氨酸。随着探索的深入,宇宙神秘的面纱正在被一点点的解开,氢原子还在不断讲述宇宙的故事。
4.7、对大爆炸理论的强力支持
故事开始于1929年,这时的天文学家发现了宇宙正在膨胀,这使原本就存在漏洞的宇宙恒稳定学说的地位更加岌岌可危,雪上加霜的是1946年伽莫夫提出了宇宙大爆炸理论,开始与老霸主争夺统治地位。
为了稳固宇宙恒稳定学说,支持者们做出了一个不合逻辑的假说,认为宇宙每过30万年每立方米空间就会产生一个氢原子,来打补丁续命。另一方面,宇宙大爆炸理论也亟需证明自己,其支持者们想出了用宇宙微波背景辐射来验证的方法:因为在大爆炸后宇宙温度随着膨胀而冷却,直到今天的3K左右,辐射波长到了微波波段(温度越低波长越长),只要能找到这种波长的微波就可以证明了。在有了方向后,美国物理学家彭齐亚斯与威尔逊在机缘巧合之下发现了证明依据,开启了宇宙起源探索新阶段。
除了背景辐射外,另一派科学家们从氢元素入手来证明大爆炸理论:依据伽莫夫的理论,在大爆炸初期只有氢、氦、锂及其同位素会生成,那么只要证明现实中特定元素的丰度与理论推断相同就可以证明了。
美国物理学家施拉姆以氘为研究对象,企图攻克这一难题。

施拉姆
第一步是理论推导氘的丰度,施拉姆通过理论证明大爆炸阶段所产生的元素的丰度只与当时的质子数与中子数有关,而当时与现在的宇宙物质总量并不会发生大改变,因此在1991年经过详细计算后,排除其它方式产生的氘,施拉姆提出在10000个氢原子中应该有接近3.5个氘原子。第二步就是实验室测算了,这一环节主要面对的问题就是排除宇宙产生140亿年来通过各种方式损耗掉的氘的影响。在1993年,夏威夷一个团队在经过多年观测后得出结论,每10000个氢原子中有大约3.4个氘原子,十分接近于施拉姆的理论值,再次大力支持了宇宙大爆炸学说。
5、后记
从宇宙诞生那一刻起,氢便占据了主导地位,在漫长的演化过程中从未缺席,存在于生活中的每个角落,与世界的生产生活息息相关。
 中国能源资讯网
中国能源资讯网


